তড়িৎ ঋণাত্মকতা কি ?
সমযোজী বন্ধনের ক্ষেত্রে বন্ধনে অংশগ্রহণকারী পরমাণুদ্বয় সমান সংখ্যক ইলেকট্রন শেয়ার করে বন্ধন গঠন করে । বন্ধন গঠন করে বন্ধনে থাকা ইলেকট্রনকে সমানভাবে ভোগ করে । একই পরমাণুর মধ্যে এই বন্ধন হলে সেক্ষেত্রে বন্ধনরত ইলেকট্রনকে উভয় পরমাণু সমান ভাবে আকর্ষন করে । কিন্তু যখন এই বন্ধ ভিন্ন পরমাণুর মধ্যে ঘটে, তখন বন্ধনরত ইলেকট্রনকে কোন একটি পরমাণু বেশি আকর্ষন করে । সমযোজী বন্ধনে শেয়ারকৃত ইলেকট্রনকে এই আকর্ষন করার ক্ষমতাকে বলা হয় তড়িৎ ঋণাত্মকতা । অর্থাৎ- সমযোজী বন্ধনে শেয়ারকৃত ইলেকট্রনকে আকর্ষন করার ক্ষমতাকে তড়িৎ ঋণাত্মকতা বলা হয় ।
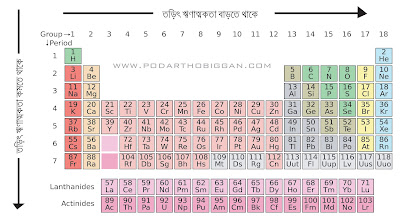
তড়িৎ ঋণাত্মকতার পর্যায়বৃত্ততা
তড়িৎ ঋণাত্মকতা নির্ভর করে, কোন মৌল নিষ্ক্রিয় গ্যাস মৌলের কত কাছে অবস্থান করে ইলেকট্রনকে আকর্ষন করতে পারে তার উপর । যেসব মৌলের সর্বশেষ শক্তিস্তরে অধিক সংখ্যক ইলেকট্রন থাকে কিন্তু পূর্ণ থাকেনা । ২-১টি ইলেকট্রন গ্রহণ করতে পারলেই অরবিটাল পূর্ণ হবে, তারা ইলেকট্রনকে অধিক পরিমাণে নিজের দিকে টানে । যেমন সোডিয়ামের সর্বশেষ শক্তিস্তরে একটি মাত্র ইলেকট্রন থাকে । অষ্টক পূর্ণ হওয়ার জন্য এর আরও ৭টি ইলেকট্রনের প্রয়োজন । আর এতগুলো ইলেকট্রন গ্রহণ সম্ভব নয় । আর তাই সোডিয়াম সর্বশেষ শক্তিস্তরের এই ইলেকট্রনটি ত্যাগ করতেই চায় । অপর দিকে ক্লোরিনের সর্বশেষ শক্তিস্তরে ৭টি ইলেকট্রন থাকে । আর একটি মাত্র ইলেকট্রন গ্রহণ করতে পারলে অষ্টক পূর্ণ হবে । তাই একটি ইলেকট্রনকে অধিক পরিমাণে আকর্ষন করে । এভাবে পর্যায় সারণির একই পর্যায়ের বাম থেকে ডান দিকে যেতে থাকলে তড়িৎ ঋণাত্মকতা বাড়তে থাকে ।
এক্ষেত্রে ইলেকট্রনকে আকর্ষন করে মূলত মৌলটির নিউক্লিয়াস । পর্যায় সারণির একই গ্রুপের উপর থেকে নিচের দিকে যেতে থাকলে পরমাণুর আকার বৃদ্ধির সাথে নিউক্লিয়াসের ইলেকট্রনকে আকর্ষন করার ক্ষমতা কমতে থাকে । ফলে তড়িৎ ঋণাত্মকতাও কমতে থাকে ।