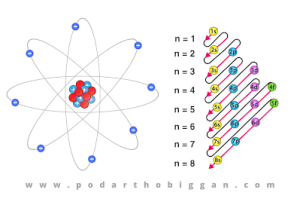
ইট্রিয়াম পর্যায় সারণির 39তম মৌল ইট্রিয়াম । এটি পঞ্চম সারির তৃতীয় কলামে অবস্থিত ।
| নাম | ইট্রিয়াম(Yttrium) |
| প্রতিক | Y |
| পারমানবিক সংখ্যা | 39 |
| পারমানবিক ভর | 88.90585 |
| ইলেকট্রন বিন্যাস | 1s2 2s2 2p6 3s2 3p6 3d10 4s24p64d15s2 |
| আইসোটোপ | ইট্রিয়াম- 77 – (ভর সংখ্যা – 77) ইট্রিয়াম- 78 – (ভর সংখ্যা – 78) ইট্রিয়াম- 79 – (ভর সংখ্যা – 79) ইট্রিয়াম- 80 – (ভর সংখ্যা – 80) ইট্রিয়াম- 81 – (ভর সংখ্যা – 81) ইট্রিয়াম- 82 – (ভর সংখ্যা – 82) ইট্রিয়াম- 83 – (ভর সংখ্যা – 83) ইট্রিয়াম- 84 – (ভর সংখ্যা – 84) ইট্রিয়াম- 85 – (ভর সংখ্যা – 85) ইট্রিয়াম- 86 – (ভর সংখ্যা – 86) ইট্রিয়াম- 87 – (ভর সংখ্যা – 87) ইট্রিয়াম- 88 – (ভর সংখ্যা – 88) ইট্রিয়াম- 89 – (ভর সংখ্যা – 89) ইট্রিয়াম- 90 – (ভর সংখ্যা – 90) ইট্রিয়াম- 91 – (ভর সংখ্যা – 91) ইট্রিয়াম- 92 – (ভর সংখ্যা – 92) ইট্রিয়াম- 93 – (ভর সংখ্যা – 93) ইট্রিয়াম- 94 – (ভর সংখ্যা – 94) ইট্রিয়াম- 95 – (ভর সংখ্যা – 95) ইট্রিয়াম- 96 – (ভর সংখ্যা – 96) ইট্রিয়াম- 97 – (ভর সংখ্যা – 97) ইট্রিয়াম- 98 – (ভর সংখ্যা – 98) ইট্রিয়াম- 99 – (ভর সংখ্যা – 99) ইট্রিয়াম- 100 – (ভর সংখ্যা – 100) ইট্রিয়াম- 101 – (ভর সংখ্যা – 101) ইট্রিয়াম- 102 – (ভর সংখ্যা – 102) ইট্রিয়াম- 103 – (ভর সংখ্যা – 103) ইট্রিয়াম- 104 – (ভর সংখ্যা – 104) ইট্রিয়াম- 105 – (ভর সংখ্যা – 105) ইট্রিয়াম- 106 – (ভর সংখ্যা – 106) ইট্রিয়াম- 107 – (ভর সংখ্যা – 107) ইট্রিয়াম- 108 – (ভর সংখ্যা – 108) ইট্রিয়াম- 109 – (ভর সংখ্যা – 109) ইট্রিয়াম- 110 – (ভর সংখ্যা – 110) ইট্রিয়াম- 111 – (ভর সংখ্যা – 111) |
| ঘনত্ব | 4.47 g/mL |
| পরমাণুর ব্যাসার্ধ | 240 pm |
| ইলেকট্রন আসক্তি | 29.6 kJ/mol |
| তড়িৎ ঋণাত্মকতা | 1.22 |
| আয়নিকরন শক্তি | প্রথম আয়নিকরন শক্তি – 600 kJ/mole দ্বিতীয় আয়নিকরন শক্তি – 1180 kJ/mole তৃতীয় আয়নিকরন শক্তি – 1980 kJ/mole চতুর্থ আয়নিকরন শক্তি – 5847 kJ/mole পঞ্চম আয়নিকরন শক্তি – 7430 kJ/mole ষষ্ট আয়নিকরন শক্তি – 8970 kJ/mole সপ্তম আয়নিকরন শক্তি – 11,190 kJ/mole অষ্টম আয়নিকরন শক্তি – 12,450 kJ/mole নবম আয়নিকরন শক্তি – 14,110 kJ/mole দশম আয়নিকরন শক্তি – 18,400 kJ/mole |
| গলনাংক | 1,526 °C |
| স্ফুটনাংক | 3,338 °C |
| উৎস | ইট্রিয়াম প্রকৃতিতে মুক্ত অবস্থায় পাওয়া যায় না কিন্তু খনিতে অন্যান্য ল্যান্থানাইড মৌলের সাথে আকরিক অবস্থায় পাওয়া যায়। |
| অন্যান্য | ১৭৯৪ সালে জোহান গ্যাদোলিন ইট্রিয়াম আবিষ্কার করেন । এটি রুপার মত দেখতে একটি অবস্থান্তর ধাতু যার রাসয়নিকধর্ম ল্যান্থানাইড মৌলগুলোর মত এবং এটি একটি বিরল মৃত্তিকা ধাতু। |